專家信息:
鐘濤,華東師范大學特聘教授,杰出青年基金獲得者,重大科學研究計劃首席科學家。鐘濤教授于1987年畢業于復旦大學醫學院(原上海醫科大學)藥物化學專業,獲得理學學位;1995年在美國紐約州立大學的紐約冷泉港研究所獲得聯合遺傳學博士;1995-2000年在美國哈佛大學醫學院的心血管研究中心從事博士后研究;2001-2010年在美國范德堡(Vanderbilt)大學醫學院先后擔任醫學系助理教授、副教授;2011年至2017年任復旦大學生命科學學院特聘教授。2017年至今任華東師范大學特聘教授;美國范德堡(Vanderbilt)大學醫學院兼職教授。
教育及工作經歷:
1982年9月-1987年6月,復旦大學醫學院(原上海醫科大學)藥物化學專業,獲學士學位。
1987年7月-1989年12月:復旦大學醫學院(原上海醫科大學) 碩士。
1995年7月-2000年8月,在美國麻省理工學院和哈佛醫學院心血管研究中心任博士后研究員。
2002年,任美國范得堡 (Vanderbilt) 大學醫學院藥理系和發育細胞生物系助理教授,醫學系副教授,復旦大學講座教授。
2011年至2017年,復旦大學生命科學學院特聘教授,遺傳工程國家重點實驗室副主任。
2017年至今任華東師范大學特聘教授;美國范德堡(Vanderbilt)大學醫學院兼職教授。
學術兼職及社會任職:
擔任多個國際學術雜志的評審專家,包括Current Biology; Development; Developmental Biology; Circulation; Chemistry & Biology。
1、國家基金會評審委員會專家。
2、科技部中期評審委員會專家。
3、美國國立衛生研究院(NIH)項目評審委員會專家。
4、美國心臟學會(AHA)項目評審委員會專家。
5、美國遺傳學學會會員, 發育生物學學會會員, 心臟協會會員。
主講課程:
秋季學期開授專業選修課《發育與疾病》。
培養研究生情況:
資料更新中……
研究方向:
長遠目標是闡明調控心血管發育和器官形成的細胞分子機制。心血管系統的動態性和復雜性使它成為既具有挑戰性又吸引人的研究對象。發育和生長失控是人類心血管疾病的主要特點。我們主要以斑馬魚和小鼠為模式動物,利用遺傳學、發育生物學和分子生物學的方法研究心臟和血管的分化形成和再生以及環境對心血管發育的影響。通過小分子化合物篩選來發現調控心血管發育和再生的信號傳導網絡和相應的藥物前體。希望我們的研究不僅有助于解密人類心血管和其他疾病的細胞分子病因,并可能為細胞再生和組織自我修復的前沿療法開辟廣闊的思路。
研究成果和方向
1)利用基因編輯工具CRISPR/Cas9構建轉基因、突變體斑馬魚以及開發更高效的單堿基編輯工具。
細胞譜系示蹤是一種研究器官發育、組織損傷以及單細胞分化命運的重要手段,誘導性重組酶Cre/Loxp系統的應用為細胞譜系示蹤技術打開了突破口。我們團隊應用CRISPR/Cas9基因編輯工具(見圖1)將外源性熒光報告基團序列或CreERT2序列定點整合到目的基因下游:①通過在斑馬魚活體中實時觀察熒光基團表達位置及強度,可以反映目的基因內源性表達位置及表達豐度,以追蹤表達此基因的細胞譜系;②通過控制外源誘導劑的時間窗口,誘導組織特異性表達的CreERT2對Loxp序列進行切割,以實現基因條件性敲除。同時,我們團隊利用優化的高效單堿基編輯工具在斑馬魚當中進行基因編輯,構建斑馬魚疾病模型以模擬人類由于單堿基突變導致的疾病,為探索和研究人類單堿基突變疾病的病理機制及治療方法奠定基礎。基因堿基編輯器主要包括腺嘌呤堿基編輯器(ABE)與胞嘧啶堿基編輯器(CBE),可以在不產生DNA 雙鏈斷裂的情況下,在編輯窗口之內分別實現A:T>G:C 或者C:G>T:A 的轉換,是基因編輯領域的顛覆性技術。我們團隊合作開發了具有超高活性的腺嘌呤單堿基編輯器(hyABE),極大地提高了靠近PAM區A-to-G的轉換效率,擴大了編輯窗口;研發的超高活性嘌呤嘧啶雙堿基編輯器(eA&C-BEs和hyA&C-BEs)大幅提高了A-to-G和C-to-T(A/C)同時的編輯效率。研究證明hyABE在斑馬魚胚胎中可以有效催化A-to-G轉換,編輯效率高達60%。hyABE能夠在F0胚胎中引入純合rps14E12G致病點突變,顯著降低血紅蛋白和紅細胞數目,與人類血細胞發育異常(MDS)疾病表型一致,展現了hyABE在構建點突變疾病模型中的優勢。同時,雙堿基編輯器eA&C-BEs和hyA&C-BEs在斑馬魚胚胎中展現出較高的A-to-G和C-to-T同時轉換效率。這些堿基編輯器的應用并沒有引起斑馬魚胚胎發育致畸表型,提供了潛在的基因治療新策略 (Nature Communications 2023) (https://www.ecnu.edu.cn/info/1094/62291.htm)。
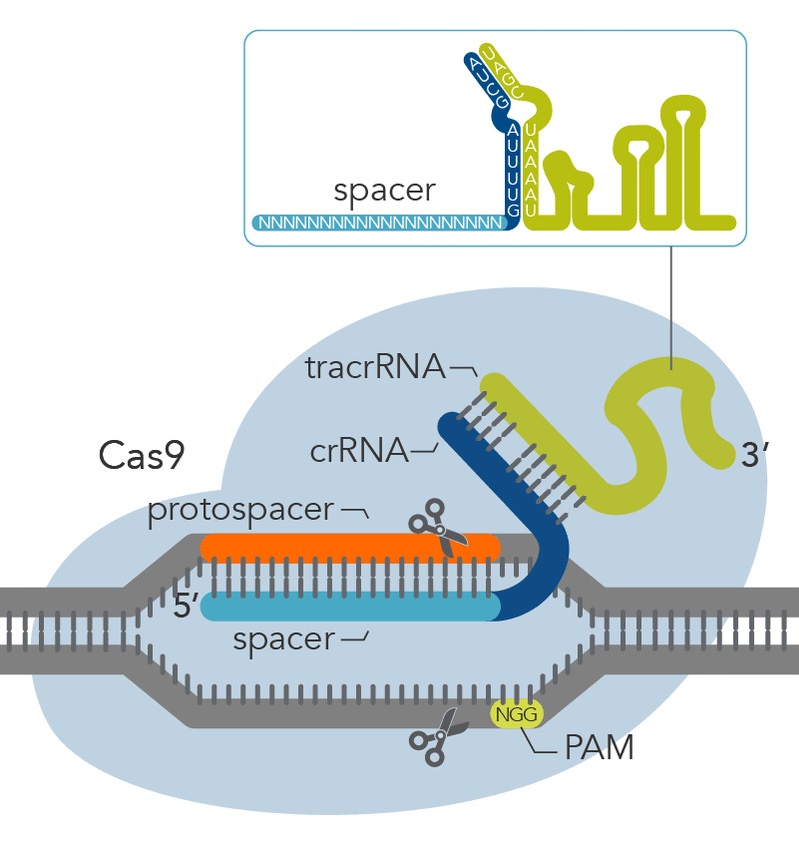
圖1.CRISPR/Cas9基本結構示意圖
2)細胞纖毛與胚胎及心臟生長發育機制研究
我們發現前列腺素信號通路調控細胞纖毛生長和心臟不對稱發育 (Nature Cell Biology, 2014;封面長文)。研究團隊以斑馬魚和人類細胞為模型,通過分析Leakytail (Lkt) 遺傳突變體,發現前列腺素轉運蛋白缺失造成心臟與其他內臟器官隨機性偏側等異常表型。證明這些異常表型主要是由于胚胎發育時期細胞表面纖毛生長缺陷所引起。研究小組進一步發現LKT轉運蛋白能夠從細胞內轉運前列腺素到細胞外,后者通過結合定位于纖毛膜上的G蛋白偶聯受體,進而影響纖毛內轉運蛋白 (IFT) 的正向速度,最終調節纖毛生長和心臟及其他內臟器官不對稱發育(見圖2)。此發現不僅揭示了在胚胎形成和器官發育中前列腺素信號的重要性,而且有助于解密人類纖毛運動綜合癥和先天性心臟病的細胞分子病因。《自然·細胞生物學》發表專題評論,認為“這項研究工作是前列腺素生理信號在發育領域的一個意想不到的重大發現”。
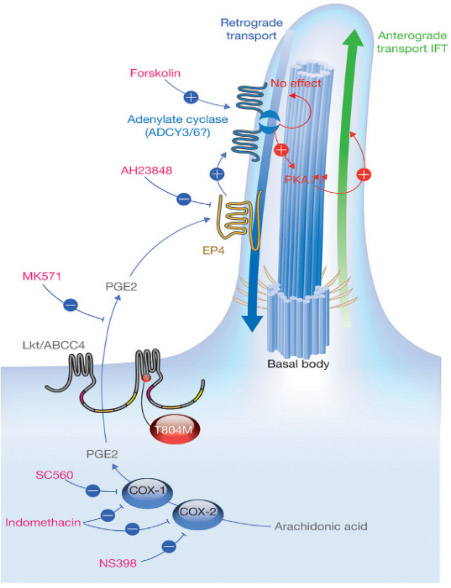
圖2.PGE2信號通路調控纖毛生長
3)探索心臟發育及再生機制
成年哺乳動物心臟受損后再生能力有限,受損后心肌細胞被纖維疤痕取代,最終導致心力衰竭。與哺乳動物心臟不同,斑馬魚心臟損傷后可以通過心肌細胞去分化和增殖實現心臟再生;新生小鼠在出生一周內,損傷的心臟也可以通過心肌去分化和增殖完成再生。哺乳動物心臟再生能力有限,主要是由于細胞內在再生屏障與分子阻滯因子的存在,內源性再生障礙和負調控因子會阻礙心臟受損后心肌細胞去分化和增殖。探究這些再生過程中機制將為人類心臟疾病治療提供新的啟示。
我們實驗室主要應用斑馬魚和小鼠作為心臟再生研究模型(見圖3)。通過構建心肌特異性過表達T-box家族的轉錄因子(tbx20)品系,我們發現心肌細胞特異性過表達tbx20可以誘導受損區心肌細胞去分化,激活心內膜細胞BMP信號通路,促進受損心肌和心內膜再生(Frontiers in Cell and Developmental Biology 2020)。同時,我們揭示了bHLH轉錄因子Gridlock(Grl)/Hey2在心臟再生中的分子屏障機制;心肌細胞中條件性誘導Grl表達能夠抑制受損后心肌細胞去分化與增殖;反之,Grl突變減少纖維化疤痕和促進心肌細胞增殖,增強心臟再生。研究表明心臟損傷誘導Grl表達下降,引起甲基轉移酶Smyd2表達升高,進而調節Stat3甲基化和磷酸化,促進受損心肌去分化和再生(Development 2020)。
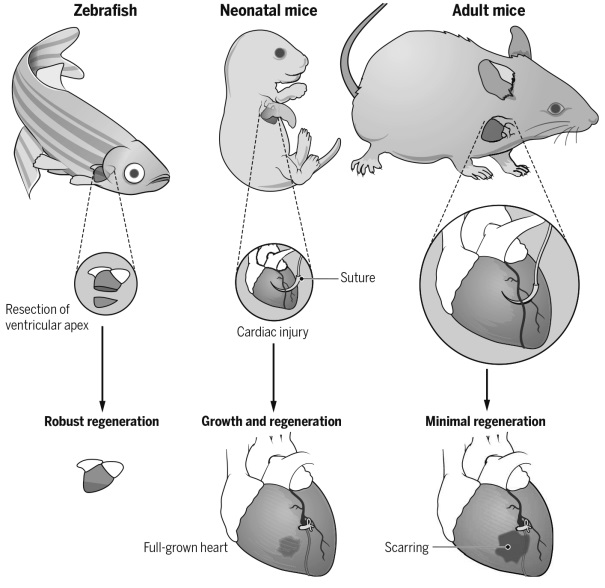
圖3.心臟再生研究中常用的模式動物
4)研究造血干細胞增殖和分化的分子及細胞機制
造血干細胞(Hematopoietic and progenitor cells, HSPCs)是一群具有增殖、分化和重建能力的異質性干祖細胞。在血液形成過程中,造血干細胞是從主動脈-性腺-中腎區(Aorta-Gonad-Mesoneph, AGM)動脈腹側生血內皮中產生,隨后遷移至哺乳動物的胎肝(Feter Liver)或斑馬魚的尾部造血組織(Caudal Hematopoietic Tissue)進行快速增殖和分化,最終定植于骨髓或腎臟,維持成體造血(見圖4)。我們研究團隊以斑馬魚和小鼠為模式生物,結合人類造血干細胞,應用發育生物學、表觀遺傳學及基因組學方法,闡明了ATF7IP/SETDB1介導的組蛋白甲基化修飾是協調HSPC干細胞狀態與多種血液譜系分化的一個關鍵檢驗點(Checkpoint),用于維持紅系、髓系和淋巴系等多種細胞的平衡分化及血液系統的正常循環與功能。機制上,atf7ip或setdb1缺失造成細胞周期負調節因子cdkn1a/p21與髓系轉錄激活因子cebpß啟動子區域H3K9me3沉積減少,染色質開放程度增加,導致cdkn1a/p21和cebpß表達增加,引起造血干細胞擴增受阻,紅系分化減少,最終促進髓系分化偏倚。同時,Atf7ip與Setdb1相互作用,沉默逆轉錄轉座子(LTR/LINE)表達,抑制Mda5/Rig-I介導的天然免疫應答以及應急引起的髓系偏倚分化。該研究揭示了ATF7IP/SETDB1介導的H3K9me3沉積和染色質重塑在控制造血干細胞擴增與多種血細胞分化中的一個重要調控機制,為急性髓系白血病及其他人類疾病的干預提供了新策略 (PNAS 2022) (https://www.ecnu.edu.cn/info/1094/61875.htm)。DHX15是一種RNA解旋酶,臨床發現AML患者存在DHX15 R222G突變,與AML患者不良預后相關。研究團隊發現dhx15 r222g突變體呈現HSPC增殖受阻的表型,證明HSPC缺陷是通過未折疊蛋白應答(UPR)通路介導,對評估AML發生和預后具有一定臨床意義(Cancer Science 2021)。
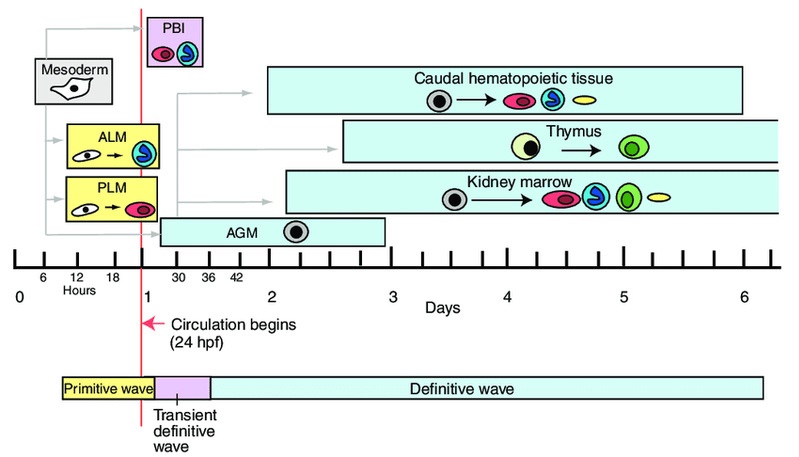
圖4.斑馬魚造血過程示意圖
承擔科研項目情況:
主持課題有:2013年度重大科學研究計劃課題;2012年國家重大科學研究計劃子課題;2012年國家自然科學基金面上項目;2011年上海市浦江人才計劃。在美國工作期間,鐘濤教授的實驗室得到美國NIH和美國心臟協會連續性的長期資助,共主持研究課題11項。
1.作為首席科學家承擔2013年度重大科學研究計劃發育與生殖研究領域“心肌細胞分化增殖與心臟發育的調控機制”項目。
科研成果:
鐘濤教授主要以斑馬魚和小鼠為模式動物,結合人類干細胞,利用遺傳學、發育生物學、化學生物學和分子生物學的方法研究心臟和血管的分化形成與再生的生物學機制。在國際科學界,第一次提出動脈血管內皮細胞在血液循環之前就已獲得分子特征的概念,發現和克隆心血管發育的核心轉錄因子Grl/Hey2家族及其上游關鍵信號NOTCH通路。率先揭示了前列腺素(PGE2)信號及其轉運蛋白(ABCC)調控細胞纖毛生長與心臟及多種器官形態發育的新穎生物學機制。以第一作者或通訊作者在包括Cell,Nature, Science, Nature Cell Biology等國際一流學術雜志上發表了80多篇文章。關于血管內皮細胞分化的研究成果被美國大學經典教科書《發育生物學》(第十版)采用(教科書級別重大成果)。
1.在心臟方面,發現調控心血管發育bHLH轉錄因子Gridlock/Hey家族,揭示Grl /Hey2與轉錄激活因子相互作用調節心臟生長的分子機理,為揭示房間隔缺損等相關先天性心臟病發生機制提供了分子基礎。
2.在血管研究方面,揭示了動脈和靜脈內皮細胞分化的分子機理,形成動靜脈分化理論,被美國經典大學教科書《Developmental Biology》(Scott Gilbert編著,2010年第九版) 采用。
3.2011年回國后,發現誘導心肌細胞增殖再生的具有新型結構的小分子先導化合物(Cardinogen family)。
4.2014年,在細胞纖毛和心臟發育研究領域取得重大進展,發現前列腺素信號通路能夠調控細胞纖毛生長和心臟左右不對稱發育,發表于國際著名細胞生物學雜志«自然*細胞生物學»。鐘濤教授在Nature、Science、Cell、PNAS等國際學術刊物發表了SCI論文逾40篇,總影響因子達390,被引用2000余次,單篇他引高達448次。
論文專著:
在Nature、Science、Cell、PNAS等國際學術刊物發表了SCI論文逾40篇,總影響因子達390,被引用2000余次,單篇他引高達448次。
代表性英文論文:
[1]Xue N, Liu X, Zhang D, Wu Y, Zhong Y, Wang J, Fan W, Jiang H, Zhu B, Ge X, Gonzalez RVL, Chen L, Zhang S, She P, Zhong Z, Sun J, Chen X, Wang L, Gu Z, Zhu P, Liu M, Li D, Zhong TP*, Zhang X*. 2023. Improving adenine and dual base editors through introduction of TadA-8e and Rad51DBD. Nature Communications. 14(1):1224. *Correspondent author
[2]Liu X, Yu T, Tan X, Jin D, Yang W, Zhang J, Dai L, He Z, Li D, Zhang Y, Liao S, Zhao J, Zhong TP*, Liu C*. 2023. Renal interstitial cells promote nephron regeneration by secreting prostaglandin E2. Elife. 12:e81438. *Correspondent author
[3]Wu J, Li J, Chen K, Liu G, Zhou Y, Chen W, Zhu X, Ni TT, Zhang B, Jin D, Li D, Kang L, Wu Y, Zhu P, Xie P, Zhong TP. 2023. Atf7ip and Setdb1 interaction orchestrates the hematopoietic stem and progenitor cell state with diverse lineage differentiation. Proc Natl Acad Sci. 120(1):e2209062120.
[4]Li D, Sun J, Zhong TP. 2022. Wnt Signaling in Heart Development and Regeneration. Curr Cardiol Rep. 24(10):1425-1438.
[5]Jin D, Zhong TP. 2022. Prostaglandin signaling in ciliogenesis and development. J Cell Physiol. 237(6):2632-2643.
[6]Liu, Xiuxiu; Pu, Wenjuan; He, Lingjuan; Li, Yan; Zhao, Huan; Li, Yi; Liu, Kuo; Huang, Xiuzhen; Weng, Wendong; Wang, Qing-Dong; Shen, Linghong; Zhong, Tao; Sun, Kun; Ardehali, Reza; He, Ben*; Zhou, Bin*.Cell proliferation fate mapping reveals regional cardiomyocyte cell-cycle activity in subendocardial muscle of left ventricle.Nature Communications, 2021, 12(1): 5784.
[7]Cai Y, Wang J, Jin D, Liu Q, Chen X, Pan L, Li Y, Wang X, Qian F, Wang J, Zhong TP*, Wang S*. 2021. Dhx15 regulates zebrafish definitive hematopoiesis through the unfolded protein response pathway. Cancer Sci. 112(9):3884-3894. *Correspondent author
[8]Wei G, Sun H, Dong K, Hu L, Wang Q, Zhuang Q, Zhu Y, Zhang X, Shao Y, Tang H, Li Z, Chen S, Lu J, Wang Y, Gan X, Zhong TP, Gui D, Hu X, Wang L, Liu J. 2021. The thermogenic activity of adjacent adipocytes fuels the progression of ccRCC and compromises anti-tumor therapeutic efficacy. Cell Metab. 33(10):2021-2039.e8.
[9]Peilu She, Huifang Zhang, Xian.gwen Peng, Jianjian Sun, Bangjun Gao, Yating Zhou, Xuejiao Zhu, Xueli Hu, Kaa Seng Lai, Jiemin Wong, Bin Zhou, Linhui Wang, Tao P. Zhong. 2020. The Gridlock/Hey2 Transcriptional Repressor Impedes Vertebrate Heart Regeneration by Restricting Expression of Lysine Methyltransferase. Development. 147(18):dev190678.
[10]Peng X, Lai KS, She P, Kang J, Wang T, Li G, Zhou Y, Sun J, Jin D, Xu X, Liao L, Liu J, Lee E, Poss KD, Zhong TP. 2021. Induction of Wnt signaling antagonists and p21-activated kinase enhances cardiomyocyte proliferation during zebrafish heart regeneration. J Mol Cell Biol. 13(1):41-58.
[11]Fang Y, Lai KS, She P, Sun J, Tao W, Zhong TP. 2020. Tbx20 Induction Promotes Zebrafish Heart Regeneration by Inducing Cardiomyocyte Dedifferentiation and Endocardial Expansion. Front Cell Dev Biol. 8:738.
[12]Sun, Yonghua; Zhang, Bo; Luo, Lingfei; Shi, De-Li; Wang, Han; Cui, Zongbin; Huang, Honghui; Cao, Ying; Shu, Xiaodong; Zhang, Wenqing; Zhou, Jianfeng; Li, Yun; Du, Jiulin; Zhao, Qingshun; Chen, Jun; Zhong, Hanbing; Zhong, Tao P.; Li, Li; Xiong, Jing-Wei; Peng, Jinrong; Xiao, Wuhan; Zhang, Jian; Yao, Jihua; Yin, Zhan; Mo, Xianming; Peng, Gang; Zhu, Jun; Chen, Yan; Zhou, Yong; Liu, Dong; Pan, Weijun; Zhang, Yiyue; Ruan, Hua; Liu, Feng; Zhu, Zuoyan; Meng, Anming; Sun, Yonghua; Pan, Luyuan. Systematic genome editing of the genes on zebrafish Chromosome 1 by CRISPR/Cas9. Genome Research, 2020, 30(1): 118-126.
[13]Zhao W, Cao L, Ying H, Zhang W, Li D, Zhu X, Xue W, Wu S, Cao M, Fu C, Qi H, Hao Y, Tang YC, Qin J, Zhong TP, Lin X, Yu L, Li X, Li L, Wu D, Pan W. 2019. Endothelial CDS2 deficiency causes VEGFA-mediated vascular regression and tumor inhibition. Cell Res. 29(11):895-910.
[14]Xie S, Fu W, Yu G, Hu X, Lai KS, Peng X, Zhou Y, Zhu X, Christov P, Sawyer L, Ni TT, Sulikowski GA, Yang Z, Lee E, Zeng C, Wang WE, Zhong TP*. Discovering small molecules as Wnt inhibitors that promote heart regeneration and injury repair. Journal of Molecular Cell Biology, 2020, 12(1): 42-54.
[15]Li G, Jin D, Zhong TP. 2019. Tubgcp3 Is Required for Retinal Progenitor Cell Proliferation During Development. Frontier in Mol Neurosci. 12:126
[16]Li, Wenyan; Jin, Daqing*; Zhong, Tao P*.Photoreceptor cell development requires prostaglandin signaling in the zebrafish retina. Biochemical and Biophysical Research Communications, 2019, 510(2): 230-235.
[17]Zhang Ruilin; He Jie; Wang Xu; Pan Weijun; Cao Ying; Zu Yao; Jiang Qiu; Du Jiulin; Zhong Tao P.Report of the Fifth Zebrafish Research Conference of China.Zebrafish, 2019, 16(1): 128-134.
[18]Yang, Xinyu; Li, Jiani; Fang, Yabo; Zhang, Zhen; Jin, Daqing; Chen, Xingdong; Zhao, Yan; Li, Mengqi; Huan, Linchun; Kent, Thomas A.; Dong, Jing-Fei; Jiang, Rongcai; Yang, Shuyuan; Jin, Li; Zhang, Jianning*; Zhong, Tao P.*; Yu, Fuli*. Rho Guanine Nucleotide Exchange Factor ARHGEF17 is a risk gene for Intracranial Aneurysms. Circulation-Genomic and Precision Medicine, 2018, 11(7): e002099. *Correspondent author
[19]Daqing Jin, Diqi Zhu, Yabo Fang, Yiwei Chen, Gaihong Yu, Weijun Pan, Dong Liu, Fen Li, Zhong TP. 2017. Vegfa signaling regulates diverse artery/vein formation in vertebrate vasculatures. J Genet Genomics. 44(10):483-492
[20]Xueying Tian, Yan Li, Lingjuan He, Hui Zhang, Xiuzhen Huang, Qiaozhen Liu, WenjuanPu, Libo Zhang, Yi Li, Huan Zhao, Zhifu Wang, Jianhong Zhu, Yu Nie, Shengshou Hu, David Sedmera, Zhong TP, Sean Wu, William Pu, Robert Anderson, Bin Zhou, Ying Yu, Li Zhang, Yan Yan, Zengyong Qiao, and Qing-Dong Wang. 2017. Identification of a hybrid myocardial zone in the mammalian heart after birth. Nature Communications. 8(1):87.
[21]Zeng S., Zhong TP. 2017. Cardioascular Research in Zebrafish. Encyclopedia of Cardiovascular Research and Medicine. vol 4. p759-770. Vasan R, Sawyer D ed. Oxford: Elsevier,inc.
[22]Peiyun Liu, Zhong TP*. 2017. MAPK/ERK signalling is required for zebrafish cardiac regeneration. Biotechnology Letters, 2017, 39(7): 1069-1077.
[23]Diqi Zhu, Yabo Fang, Kun Gao, Jie Shen, Zhong TP+ and Fen Li+. 2017. Vegfa Impacts Early Myocardium Development. Int J Mol Sci. 18(2). +Correspondent author
[24]Da Wo, Jinhui Peng, Dan-ni Ren, Liman Qiu, Jinxiao Chen, Ye Zhu, Yingjing Yan,Hongwei Yan, Jian Wu, En Ma, Zhong TP, Yi-Han Chen, Zhong-Min Liu, Shangfeng Liu, Luoquan Ao, Zhenping Liu, Cizhong Jiang, Jun Peng, Yunzeng Zou, Qirong Qian, Weidong Zhu. 2016. Opposing Roles of Wnt Inhibitors IGFBP-4 and Dkk1 in Cardiac Ischemia by Differential Targeting of LRP5/6 and β–catenin. Circulation. 134(24):1991-2007.
[25]Sun Jianjian, Zhihan Wu and Zhong TP. 2016. Cila Function in Cell Signaling and Organ Development. Scientia Sinica Vitae. 46,4:354-62
[26]Peng Xiangwen; He Quanze; Li Guobao; Ma Jinmin; Zhong Tao P*. Rac1-PAK2 pathway is essential for heart regeneration. Biochemical and Biophysical Research Communications, 2016, 472(4): 637-642.
[27]Li, Qiao; Yang, Hao; Zhong, Tao P*. Regeneration across Metazoan Phylogeny: Lessons from Model Organisms. J Genet Genomics. 42:57-70.
[28]Nan Wu, Xuan Ming, Jianqiu Xiao, Zhihong Wu, Xiaoli Chen, Marwan Shinawi, Yiping Shen, Guangju Yu, Jiaqi Liu, Hua Xie, Zoran S. Gucev, Sen Liu, Nan Yang, Hussam Al-Kateb, Jun Chen, Jian Zhang, Natalie Hauser, Ting Zhang, Velibor Tasic, Pengfei Liu, Xinlin Su, Xuedong Pan, Chunyu Liu, Liwen Wang, Joseph Shen, Jianxiong Shen, Yulin Chen, Ting Zhang, Jianguo Zhang, Kwong Wai Choy, Jun Wang, Qiqi Wang, Shugang Li, Weichen Zhou, Jin Guo, Yipeng Wang, Cheng Zhang, Hong Zhao, Yu An, Yu Zhao, Jiucun Wang, Zhenlei Liu, Yuzhi Zuo, V. Reid Sutton, Hongyan Wang, Yue Ming, Shashikant Kulkarni, Zhong TP, Sau Wai Cheung,Xue Zhang, Li Jin, James R. Lupski, Guixing Qiu, and Feng Zhang. 2015. Compound Inheritance of TBX6 Rare Null Variants and a Common Hypomorphic Allele in Congenital Scoliosis. New England Journal of Medicine. 372(4):341-50.
[29]Jin D, Liu PY, Zhong TP. 2015. Prostaglandin Signaling in Ciliogenesis during Development. Cell Cycle. 14 (1):1-2.
[30]Tian, Xueying; Hu, Tianyuan; Zhang, Hui; He, Lingjuan; Huang, Xiuzhen; Liu, Qiaozhen; Yu, Wei; He, Liang; Yang, Zhen; Yan, Yan; Yang, Xiao; Zhong, Tao P; Pu, William T; Zhou, Bin. De Novo formation of a distinct coronary vascular population in neonatal heart. Science, 2014, 345(6192): 90-94..
[31]Du, Xingrong; Shi, Hao; Li, Jiang; Dong, Yongli; Liang, JieLiang; Ye, Jian; Kong, Shanshan; Zhang, Shujing; Zhong, Tao; Yuan, Zengqiang; Xu, Tian; Zhuang, Yuan; Zheng, Biao; Geng, Jian-Guo; Tao, Wufan. Mst1/Mst2 regulate development and function of regulatory T cells through modulation of Foxo1/Foxo3 stability in autoimmune disease. The Journal of Immunology, 2014, 192(4): 1525-1535.
[32]Jin D, Ni TT, Sun J, Wan H, Amack JD, Yu G, Fleming J, Chiang C, Li W, Papierniak A, Cheepala S, Conseil G, Cole SP, Zhou B, Drummond IA, Schuetz JD, Malicki J, Zhong TP. 2014. Prostaglandin signaling regulates ciliogenesis and heart development by modulating intraflagellar transport. Nature Cell Biology.16 (9):841-51. (Article & Cover story; Previews by Barbry P & Zaragosi L E : An ABC of ciliogenesis. 2014. Nature Cell Biololgy. 16(9):826-7).
[33]Dai X, She P, Chi F, Feng Y, Liu H, Jin D, Zhao Y, Guo X, Jiang D, Guan KL, Zhong TP, Zhao B. 2013. Phosphorylation of angiomotin by Lats1/2 kinases inhibits F-actin binding, cell migration and angiogenesis. J Biol Chem. 288 (47):34041-51.
[34]Sun YP, Dong ZQ, Jin TH, Ang KK, Huang M, Haston KM, Peng J, Zhong TP, Finkbeiner, S, Weiss WA, Jan LY, Guo S. 2013. Imaging-based chemical screening reveals activity-dependent neural differentiation of pluripotent stem cells. Elife. e00508 (HHMI Press)
[35]Cheepala SB, Bao J, Nachagari D, Sun D, Wang Y, Zhong TP, Naren AP, Zheng J, Schuetz JD. 2013. Crucial role for phylogenetically conserved cytoplasmic loop3 inABCC4 expression. J Biol Chem. 288(31):22207-18.
[36]Tian X, Hu T, Zhang H, He L, Huang X, Liu Q, Yu W, He L, Yang Z, Zhang Z, Zhong TP, Yang X, Yang Z, Yan Y, Baldini A, Sun Y, Lu J, Schwartz RJ, Evans SM, Gittenberger-de Groot AC, Red-Horse K, Zhou B. 2013. Subepicardial endothelial cells invade the embryonic ventricle wall to form coronary arteries. Cell Research. 14 (5):371-45 (NaturePress)
[37]Xiang Y, Cho PH, Zeng X, Zheng XJ, Jessen JR, Zhong TP, Xu XL. 2013. Trapping Cardiac Recessive Mutants via Expression-based Insertional Mutagenesis Screening. Circulation Research. 112 (4):606-17
[38]Jin DQ, Li Q and Zhong TP. 2013. Chemical Genetics in Cardiomyocyte Generation. Chapter III in “Chemical Biology in Regenerative Medicine: Bridging Stem Cells and Future Therapies”. Wiley Publication, inc. USA
[39]Ni TT, Lu J, Zhu M, Maddison LA, Boyd KL, Huskey L, Ju B, Hesselson D, Zhong TP, Page- McCaw PS, Stainier DY, Chen W. 2012. Conditional control of gene function by an invertible gene trap in zebrafish. Proc Natl Acad Sci. 109:15389-94.
[40]Ni, Terri T; Rellinger, Eric J; Mukherjee, Amrita; Xie, Shuying; Stephens, Lauren; Thorne, Curtis A; Kim, Kwangho; Hu, Jiangyong; Lee, Ethan; Marnett, Larry; Hatzopoulos, Antonis K; Zhong, Tao P*. Discovering small molecules that promote cardiomyocyte generation via modulating Wnt signaling. Chemistry & Biology. 8:1658-1668 (CellPress). (Previews by Ruey J. Yeh: A Wnt Inhibitors with a Twist. Chemistry & Biology. 18:1518-1520, 2011; Lab Reports, JAMA 307:5, 446, 2012)
[41]Chopra SS, Watanabe V, Yang T, Stroud DM, Burns CG, Wells S, Zhong TP+, Roden DM. 2010. A non-electrogenic requirement for voltage-gated sodium channels in zebrafish heart development. Circulation Research. 106:1342-50. +Correspondent author
[42]Williams, Charles; Kim, Seok-Hyung; Ni, Terri T; Mitchell, Lauren; Ro, Hyunju; Penn, John S; Baldwin, Scott H; Solnica-Krezel, Lila; Zhong, Tao P*. Hedgehog signaling induces arterial endothelial cell formation by repressing venous cell fate. Developmental Biology, 2010, 341(1): 196-204.
[43]Jin D, Ni TT, Hou J, Rellinger E, Zhong TP. 2009. Promoter analysis of ventricular myosin heavy chain (vmhc) in zebrafish embryos. Developmental Dynamics. 238,1760-1767
[44]Zeng X, Zheng XJ, Xiang Y, Cho PH, Jessen JR, Zhong TP, Solnica-Krezel L and Brown AL. 2009. Phospholipase D1 is required for angiogenesis of intersegmental blood vessels in zebrafish. Developmental Biology. 328,363-76
[45]Ni TT, William L, Shyr Y, Zhong TP. 2008. Use of normalization methods for analysis of microarrays containing ahigh degree of gene effects. BMC Bioinformatics. 9, 505.
[46]Qu XH, Jia HB, Garrity DM, Tompkins K, Batts L, Appel B, Zhong TP+, Baldwin S. 2008. Ndrg4is required for normal myocyte proliferation during early cardiac development in zebrafish. Developmental Biology. 317, 486-96. +Correspondent author
[47]Wang YX, Qian LX, Liu D, Yao LL, Gui YH, Zhong TP. Song HY. 2007. Bone morphogenetic protein-2 acts upstream of myocyte-specific enhancer factor 2a to control embryonic cardiac contractility. Cardiovascular Research. 74 (2):290-303.
[48]Chopra S, Hiroshi Watanable, Zhong TP+, Roden D. 2007. Molecular cloning and analysis of zebrafish voltage-gated sodium channel b-subunits: Implication for the evolution of electrical signaling in vertebrates. BMC Evolution Biology. 7, 113-7. +Correspondent author.
[49]Chopra S and Zhong TP. 2007. Vascular Development in Zebrafish. Endothelial Biomedicine. 1107-1127. Cambridge: Cambridge University Press, UK.
[50]Jia H, King I, Chopra S, Wan H, Ni T, Jiang C, Guan X, Well S, Srivastava D and Zhong TP. 2007. Vertebrate heart growth is regulated by functional antagonism between Gridlock and Gata5. Proc Natl Acad Sci. 104,14008-14013.
[51]Campbell WA, Yang H, Zetterberg H, Baulac S, Sears JA, Liu T, Wong STC, Zhong TP, XiaW. 2006. Zebrafish lacking Alzheimer presenilin enhancer 2 (Pen-2) demonstrate excessive p53 dependent apoptosis and neuronal loss. J Neurochemistry. 96,1423-40.
[52]Rutenberg JB, Fischer A., Jia HB, Gessler M., Zhong TP and Mercola M. 2006. Developmental patterning of the cardiac atrioventricular canal by Notch and Hairy-related transcription factors. Development. 133,4381-90.
[53]Wang Y, Zhong TP, Qian L, Dong Y, Jiang Q, Tan L, Song H. 2005. Wortmannin induces zebrafish cardia bifida through a mechanism independent of phosphoinositide 3-kinase and myocisn light chain kinase. Biochem Biophys Res Commun. 331 (1):303-8
[54]Zhang L, Zhong TP, Wang Y, Jiang Q, Song H, Gui Y. 2005. TBX1, a DiGeorge syndrome candidate gene, is inhibited by retinoic acid. Int. J. Developmental Biology. 50:55-61
[55]Wang Y, Qian L, Zhang Y, Jiang Q, Dong Y, Liu X, Yang X, Zhong TP+, Song H. 2005. Requirements of myocyte-specific enhancer factor 2A in zebrafish cardiac contractility. FEBS. 579, 4843-50. +Correspondent author
[56]Zhong TP. 2005. Zebrafish Genetics and Formation of Embryonic Vasculature. Current Topics in Development Biology. 71,53-81.
[57]Peterson R, Shaw SY, Peterson TA, Milan DJ, Zhong Tao P, Schreiber S, Mac Rae C and Fishman, MC. 2004. Chemical suppression of a genetic mutation in a zebrafish model of aortic coarctation. Nature Biotechnology. 22, 593-599.
[58]Xu X, Miller S, Zhong TP, Mohideen M, Crossley DA, Burggren WW and Fishman MC. 2002. Cardiomyopathy in zebrafish due to mutation in an alternatively spliced exon of Titin. Nature Genetics. 30, 205-209.
[59]Zhong TP, Childes S, Leu J, Fishman MC. 2001. The Gridlock signaling pathway fashions the first embryonic artery. Nature. 414, 216-220. (Comment by George D. Yancopoulos: Gridlock in the blood. Nature. 404, 163-164)
[60]Zhong TP, Rosenberg M, Mohideen M, Weinstein B, Fishman MC. 2000. Gridlock, an HLH gene required for assembly of the aorta in zebrafish. Science. 287, 1820-1824.
[61]Amemiya C, Zhong TP, Silverman G, Fishman MC, Zon L. 1999. In the zebrafish: Genetics and Genomics. Methods in Cell Biol. H.W. Detrich, III, M. Westerfield, L.I. Zon, Eds. (Academic Press, San Diego) pp.236.
[62]Zhong TP, Kaphingst K, Akella U, Haldi M, Lander E and Fishman MC. 1998. Zebrafish genomic library in yeast artificial chromosome. Genomics. 48, 136-138.
[63]Zhong TP, Luke M and Arndt K. 1996. Transcriptional regulation of the yeast DnaJ molecule SIS1 gene. J. Biological Chemistry. 271, 1349-1356.
[64]Zhong TP and Arndt K. 1993. Yeast SIS1 protein, a DnaJ homologue, is required for the Initiation of translation. Cell. 73, 1175-1186.
[65]Sarabia M, Sutton A, Zhong TP and Arndt K. 1992. SIT4 protein phosphatase is required for the normal accumulation of SWI4, CLN1, CLN2, and HCS26 RNAs during Late G1. Genes & Development. 6, 2417-2428.
代表性中文論文:
[1]孫建建; 鐘濤; 朱平*.Cardiac fibrosis: Histological features, molecular pathways and therapeutic targets.South China Journal of Cardiology, 2022, 23(02): 115-128.
[2]張琳; 靳大慶*; 鐘濤*.斑馬魚皮膚黑色素小體聚集和分散的機制研究.生物學教學, 2022, 47(10): 2-5.
[3]劉旭; 仲祉霖; 鐘濤*.堿基編輯器的研發及其應用.中國細胞生物學學報, 2022, 44(12): 2294-2304.
[4]孫建建, 武子涵, 鐘濤. 細胞纖毛在信號轉導與器官發育中的作用與機制[J]. 中國科學:生命科學, 2016, 46 (04): 354-362.
[5]孫淑娜, 桂永浩, 蔣璆, 宋后燕, 鐘濤. 葉酸缺乏對斑馬魚胚胎造血系統影響的初步研究[J]. 營養學報, 2010, 32 (01): 21-25.
[6]孫淑娜, 桂永浩, 宋后燕, 鐘濤, 王躍祥, 蔣璆. 葉酸拮抗劑甲氨喋呤導致斑馬魚心臟發育異常及BMP2b HAS2表達下調[J]. 中國當代兒科雜志, 2007, (02): 159-163.
[7]張立鳳, 桂永浩, 鐘濤, 王躍祥, 錢林溪, 董永新, 蔣璆, 孫淑娜, 宋后燕. 外源性視黃酸對斑馬魚Tbx1基因的影響[J]. 中華兒科雜志, 2007, 45 (04): 267-271.
[8]張立鳳, 桂永浩, 鐘濤, 王躍祥, 蔣球, 崇梅, 孫淑娜, 宋后燕. 視黃酸影響斑馬魚胚胎心臟房室分化[J]. 復旦學報(醫學版), 2007, (01): 88-91.
[9]張立鳳, 鐘濤, 桂永浩. 外源性視黃酸對斑馬魚心血管系統發育的影響[J]. 中國實驗動物學報, 2006, (02): 84-88+73-74.
[10]劉學飛, 王躍祥, 蔣璆, 錢林溪, 高廣文, 董永新, 鐘濤, 宋后燕. 斑馬魚胚胎發育過程中Mef2c的表達[J]. 復旦學報(醫學版), 2006, (01): 89-91+143.
[11]錢林溪,王躍祥,蔣璆,鐘濤,宋后燕. 乙醇干擾斑馬魚胚胎發育中底索和背主動脈的形成[J]. 中國科學(C輯:生命科學), 2005, (04): 326-332.
[12]錢林溪,鐘濤,宋后燕. 斑馬魚早期內胚層發育及其分子調控機制[J]. 生命的化學, 2005, (04): 297-299.
[13]王躍祥,鐘濤,宋后燕. 斑馬魚發育遺傳學研究進展[J]. 國外醫學.遺傳學分冊, 2004, (04): 220-223.
[14]高廣文,鐘濤,宋后燕. 斑馬魚外胚層早期發育及其某些調控機制[J]. 生命的化學, 2004, (03): 227-229.
[15]陳新明,鐘濤,萬鈞,吳杰,張世永. WWW搜索引擎的數據采集技術[J]. 計算機工程與應用, 2002, (07): 145-147+161.
[16]鐘濤,李微剛,張世永. 基于高速IP網的遠程教育系統[J]. 計算機工程與應用, 2001, (20): 126-128.
[17]鐘濤,陳新明,萬鈞,張世永. 中文文本WEB搜索引擎的設計與實現[J]. 計算機工程與應用, 2001, (17): 149-151+169.
會議論文:
[1]鐘濤. (2014). Regulation of vertebrate ciliogenesis and heart development. (eds.) 第三屆“模式生物與人類健康”發育遺傳學全國學術研討會論文集 (pp.78).
[2]侯佳, 桂永浩, 張立鳳, 王躍祥, 宋后燕 & 鐘濤. (2008). 視黃酸缺乏對斑馬魚胚胎心臟發育的影響. (eds.) 中華醫學會第五次全國兒科中青年學術交流大會論文匯編(上冊) (pp.440-448).
[3]孫淑娜, 桂永浩, 蔣瓔, 宋后燕 & 鐘濤. (2008). 葉酸對斑馬魚胚胎心臟發育影響的實驗研究. (eds.) 中華醫學會第五次全國兒科中青年學術交流大會論文匯編(上冊) (pp.470-477).
[4]孫淑娜, 宋后燕, 鐘濤, 王躍祥 & 桂永浩. (2006). 葉酸缺乏導致先天性心血管疾病的實驗動物研究. (eds.) 2006(第三屆)江浙滬兒科學術會議暨浙江省兒科學術年會論文匯編 (pp.197).
[5]張立鳳,桂永浩,鐘濤,王躍祥,蔣球,崇梅... & 宋后燕. (2006). 視黃酸影響胚胎心臟房室分化的實驗研究. (eds.) 2006(第三屆)江浙滬兒科學術會議暨浙江省兒科學術年會論文匯編 (pp.211).
[6]張立鳳,桂永浩,王躍祥,錢林溪,董永新,蔣璆... & 宋后燕. (2006). Tbx1基因影響胚胎咽弓和心臟發育的實驗研究. (eds.) 2006(第三屆)江浙滬兒科學術會議暨浙江省兒科學術年會論文匯編 (pp.211-212).
[7]孫淑娜, 桂永浩, 宋后燕, 王躍祥 & 鐘濤. (2006). 葉酸缺乏導致先天性心血管疾病的實驗動物研究. (eds.) 中華醫學會第十四次全國兒科學術會議論文匯編 (pp.456-457).
團隊成員:
教授:鐘濤
副教授:靳大慶、李東亮
博士后:佘培露、孫建建、胡雪麗
博士研究生:高邦君、朱雪嬌、周亞婷、吳佳欣、李娟、劉旭、陳業偉
碩士研究生:賀淵、張琳、苗婷婷、強夢軻、仲祉霖、陳雯琪、萬萌、史西亞、漆瑤、莫菲、張人杰
團隊活動



學生榮譽:



榮譽獎勵:
1. 上海“**計劃”專家。
2. 國家杰出青年科學基金獎(B類)。
3. 科學中國人(2014)年度人物。
4. 施李月卿杰出畢業生(原上海醫科大學)。
5. American Heart Association Research Awards.
6. March of Dimes Research Award (USA).
7. NIH Grant Awards (USA).
8. NIH Postdoctoral Fellowship (USA).
第三場博思青年學者講壇成功舉行
2013年9月15日,博思講壇第三場青年學者講壇在立人生物樓107室舉行,拉開了新學期博思講壇系列活動的帷幕。此次青年學者講壇邀請到了來自中科院上海生化與細胞所的顧天鵬、施小山;來自中科院上海生命科學院健康所的宋昕陽和來自第二軍醫大學的馮家烜與復旦大學生命科學學院的同學們分享科研成果與經驗。這四位同學均是被譽為華人生物學在讀博士最高獎項的吳瑞獎學金得主。

首先,生命科學學院的鐘濤教授致辭,勉勵同學做科研要有全心全意的投入精神、大膽的創新精神和積極主動的交流合作能力,并努力向兄弟院校的優秀博士生學習。
接下來,宋昕陽博士以“腸道抗感染免疫中的新白介素及其受體”為題,介紹了新型白介素17受體E的發現過程和它在腸道抗感染免疫中的功能,并介紹失調的腸道菌群通過白介素17C的表達促進腸道腫瘤的發生作用機制。施小山做了“鈣離子調控T細胞抗原受體活化的機制”的報告,他向大家展示了鈣離子可以在T細胞初始刺激后調控細胞質膜的帶電性,最終促進適應性免疫功能開啟的證據。顧天鵬則介紹了早期胚胎發育過程中受精卵內雄核源DNA主動去甲基化發生機制及其生物學意義。馮家烜展示了他關于主動脈夾層腔內支架改進和動脈內膜生物力學研究的創新成果。
在最后的互動提問環節,大家探討了如何應對科研過程中遇到的困難、如何建立自信心、研究生新生如何做好研究和學習的規劃等問題。四位演講者以親身經歷告訴大家,研究生學習的早期重心應放在知識的儲備和能力的提升上;先動腦再動手,效率高;遇到困難不要輕易放棄,學會創造條件,讓自己的結果得到認可;要樂于同他人交流分享,積極合作。同學們表示聽了他們的報告,很受鼓舞,更加堅定了努力科研的決心。

博思講壇成立于2012年11月,是由復旦大學生命科學學院研究生發起,遺傳工程國家重點實驗室經費支持,學生自主推選和邀請生命科學領域杰出科學家(大師講壇)和優秀學生代表(青年學者講壇)與學生交流的論壇。從成立至今已經舉辦十幾場活動,為生命科學領域的研究生搭建了一個良好的學術交流平臺。
來源:復旦大學生命科學學院 2013-09-18
中國科技創新人物云平臺暨“互聯網+”科技創新人物開放共享平臺(簡稱:中國科技創新人物云平臺)免責聲明:
1、中國科技創新人物云平臺是:“互聯網+科技創新人物”的大型云平臺,平臺主要發揮互聯網在生產要素配置中的優化和集成作用,將互聯網與科技創新人物的創新成果深度融合于經濟社會各領域之中,提升實體經濟的創新力和生產力,形成更廣泛的以互聯網為基礎設施和實現工具的經濟發展新形態,實現融合創新,為大眾創業,萬眾創新提供智力支持,為產業智能化提供支撐,加快形成經濟發展新動能,促進國民經濟提質增效升級。
2、中國科技創新人物云平臺暨“互聯網+”科技創新人物開放共享平臺內容來源于互聯網,信息都是采用計算機手段與相關數據庫信息自動匹配提取數據生成,并不意味著贊同其觀點或證實其內容的真實性,如果發現信息存在錯誤或者偏差,歡迎隨時與我們聯系,以便進行更新完善。
3、如果您認為本詞條還有待完善,請編輯詞條。
4、如果發現中國科技創新人物云平臺提供的內容有誤或轉載稿涉及版權等問題,請及時向本站反饋,網站編輯部郵箱:kjcxac@126.com。
5、中國科技創新人物云平臺建設中盡最大努力保證數據的真實可靠,但由于一些信息難于確認不可避免產生錯誤。因此,平臺信息僅供參考,對于使用平臺信息而引起的任何爭議,平臺概不承擔任何責任。

















